大脑是神经系统的最高级中枢,控制着诸如感知、运动、语言、思维、认知等高级神经活动。研究大脑神经系统发育及其调控机制,对加强对神经系统的认知,以及诊断治疗神经系统相关疾病有着至关重要的作用和意义。放射状胶质细胞是哺乳动物大脑发育关键的神经前体细胞,其分裂产生大脑皮层几乎所有的神经元和胶质细胞。在大脑发育过程中,放射状胶质细胞的行为高度有序【1】。中心体作为动物细胞主要的微管组织中心,调控细胞周期进程,对大脑神经系统发育起着重要的调控作用【2】。通常中心体位于细胞核附近的细胞质中,然而,在放射状胶质细胞内中心体的定位十分独特,位于远离细胞核的顶端细胞膜上,即脑室腔的表面上【3,4】。这种独特的亚细胞特征已被发现数十年,然而其成因及功能一直令人困惑。
3月25日,清华大学时松海教授和结构生物学高精尖创新中心史航研究员课题组在《自然》(Nature)杂志在线发表了题为“中心体的锚定调控神经前体细胞特性和大脑皮层的形成”(Centrosome anchoring regulates progenitor properties and cortical formation)的研究论文,首次揭示了中心体调控哺乳动物大脑皮层神经前体细胞机械特性和分裂能力,进而影响大脑皮层的大小和折叠的崭新机制。

在这篇文章中,研究人员首先采用基于透射电镜成像的连续超薄切片技术对胚胎期小鼠脑组织进行观察,首次观察到了放射状胶质细胞内的中心体是通过附着在母体中心粒上的远端附属物(distal appendages)锚定在顶端细胞膜上的(图1 )。
为了探索中心体定位的分子调控机制和生理功能,研究人员特异性地去除了大脑皮层放射状胶质细胞内远端附属物的重要构成蛋白CEP83,使得母体中心粒上不再形成远端附属物,导致中心体和顶端膜发生微小的错位,从而阻止了中心体与细胞膜的锚定和连接(图1 )。
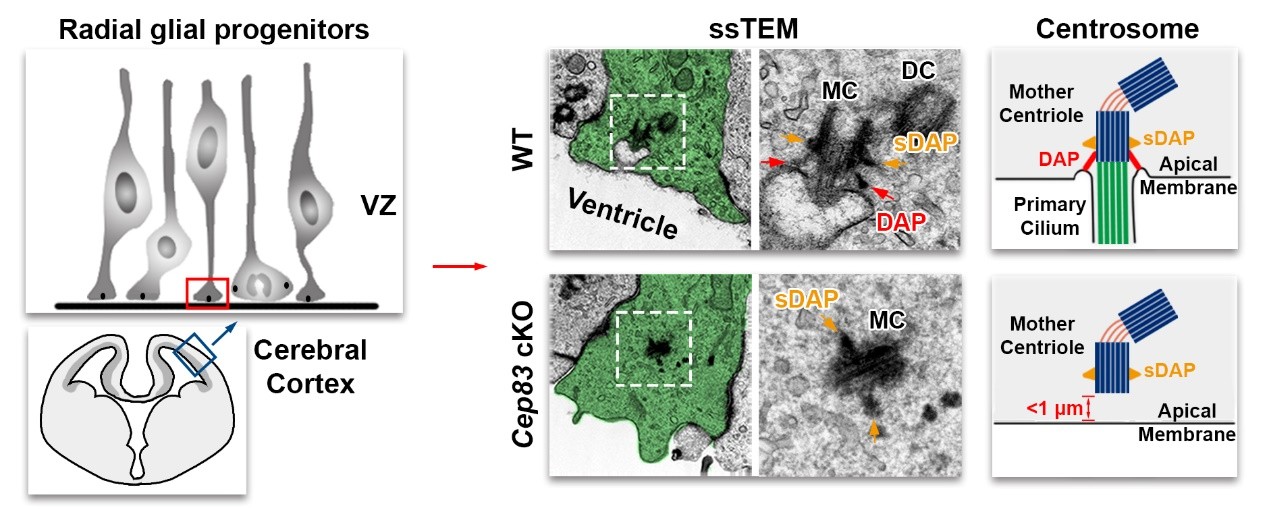
【图1】中心体通过远端附属物锚定在顶端膜上。
有趣的是,特异性地破坏放射状胶质细胞内中心体的锚定后,小鼠成年后的脑皮层体积明显增大,且在皮层的背侧中缝区普遍存在异常折叠(图2 A)。进一步的研究发现这一异常表型来源于放射状胶质细胞在神经发生早期的过度增殖和之后中间前体细胞的增多(图2 B)。
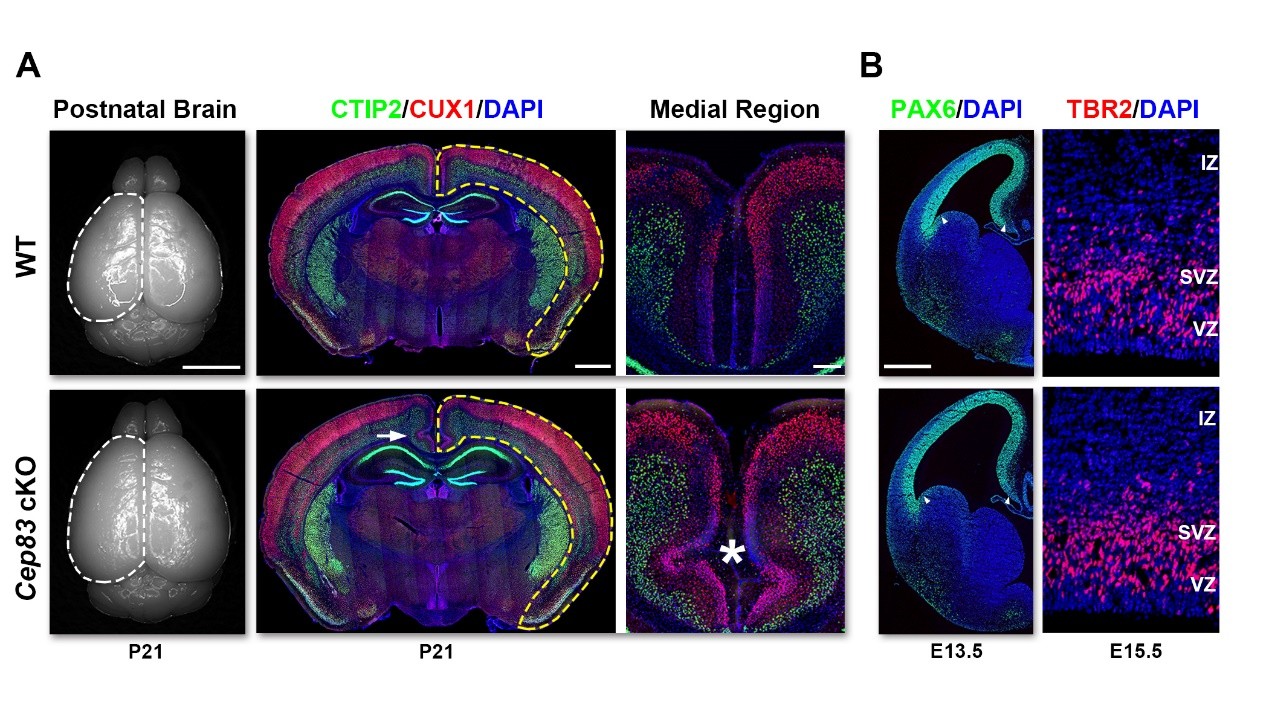
【图2】CEP83特异性敲除导致皮层体积增大和异常折叠。
神经发生的异常是如何导致的呢?再进一步的研究发现中心体这一不足1微米的错位破坏了顶端膜上特有的环状微管结构,导致顶端膜被拉伸、变硬。顶端膜物理特性的改变引起了放射状胶质细胞内机械敏感信号通路相关的YAP蛋白(Yes-associated protein)的过度激活,从而导致了放射状胶质细胞前期的过度扩增以及之后中间前体细胞的增多,最终使得大脑皮层神经细胞数量显著增加,皮层体积扩大,并引发异常折叠。与之相吻合的是,同时特异性敲除YAP可以恢复皮层体积至正常水平,不再发生折叠(图3)。
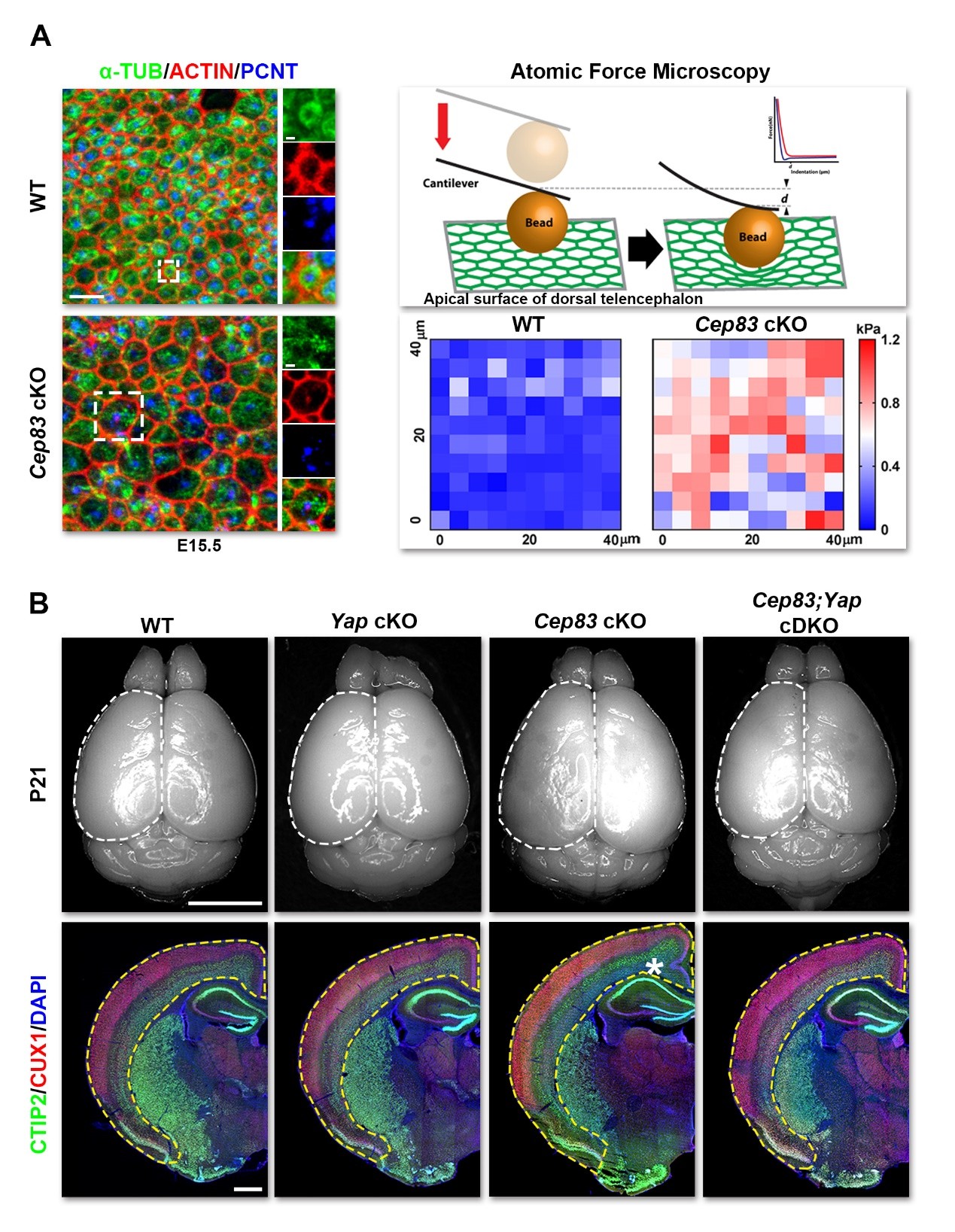
【图3】中心体锚定调节放射状胶质细胞顶端膜机械特性和YAP信号,导致神经细胞数量增多和皮层体积扩增
该研究解决了长期以来关于放射状胶质细胞内中心体特殊定位的原因和作用谜题,为研究神经前体细胞行为和皮层发育调控提供了全新的角度。另外,之前研究表明中心体蛋白相关的突变一般与小头症(microcephaly)紧密相关,然而该研究发现中心体蛋白突变导致大头症,并首次揭示了其机制。更重要的是,人类CEP83双等位基因突变会导致脑室体积增大,智力障碍和小儿肾消耗症,该研究为揭示人皮层形态和智力异常提供了重要线索。
康奈尔医学院的Wei Shao与清华大学生命科学学院的博士生杨嘉俊为本文共同第一作者。北京大学生命学院博士生贺明、清华大学生命学院博士生于翔宇、康奈尔医学院Zhaohui Yang、纪念斯隆凯特琳癌症研究中心Alexandra L. Joyner、Kathryn V. Anderson、Meng-Fu Bryan Tsou、纽约大学医学院Choong Heon Lee、Jiangyang Zhang参与本文研究。清华大学时松海教授和结构生物学高精尖创新中心史航研究员为本文共同通讯作者。本研究受到清华-北大生命联合中心、北京市结构生物学高精尖创新中心和北京生物结构前沿研究中心、北京市卓越青年科学家、美国NIH、霍华德·休斯医学研究所等项目的支持。
文章链接: https://www.nature.com/articles/s41586-020-2139-6
参考文献
【1】 Gao, P., Postiglione Pia, M., Krieger, T.G., Hernandez, L., T., Wang, C., Han, Z., Streicher, C., Papusheva,E., Insolera, R., Chugh, K., Kodish, O., Huang, K., Simons, B.D., Luo, L., Hippenmeyer, S., and Shi, S.-H. (2014) Deterministic Progenitor Behavior and Unitary Production of Neurons in the Neocortex. Cell 159:775-788.
【2】 Insolera, R., Bazzi, H., W. Shao, Anderson, K.V., and Shi, S.-H. (2014) Cortical Neurogenesis in the Absence of Centrioles. Nat. Neurosci. 17:1528-1535
【3】 Wang, X., Tsai, J.-W., Imai, J.H., Lin, W.-N., Valle, R.B., and Shi, S.-H. (2009) Asymmetric Centrosome Inheritance Maintains Neural Progenitors in the Neocortex. Nature 461: 947-955.
【4】 Bultje, R.S., Castaneda-Castellanos, D.R., Jan, L.Y., Jan, Y.N., Kriegstein, A.R., and Shi, S.-H. (2009) Mammalian Par3 Regulates Progenitor Cell Asymmetric Division via Notch Signaling in the Developing Neocortex. Neuron 63: 189-202